I tre autori hanno messo a disposizione dei lettori di NocciolaRe questo approfondito studio sull’andamento della presenza della cimice asiatica nel noccioleto, la diversa incidenza dei frutti danneggiati in relazione allo stadio fenologico delle nocciole (diverso tra le due varietà) e la valutazione dell’efficacia dei trattamenti insetticidi per ridurre i danni dei frutti ad un livello accettabile. Quest’ultima è stata confermata, ma per ottenere risultati migliori è necessario considerare i diversi stadi di crescita del seme (diversi tra le varietà), intervenendo in quelli più sensibili, oltre che la densità della popolazione di cimici.
Ringraziamo in particolare la Dott.ssa Flavia De Benedetta che ha tradotto il lavoro originale pubblicato in inglese e scaricabile a questo link: https://www.mdpi.com/2311-7524/9/6/727
Relazione tra sviluppo del frutto e incidenza del danno da Halyomorpha halys su nocciolo, cultivar Tonda Romana e San Giovanni
Flavia De Benedetta1,2, Matteo Giaccone3, Umberto Bernardo1
1Consiglio Nazionale delle Ricerche, Istituto per la Protezione Sostenibile delle Piante-IPSP-CNR, P.le E. Fermi, 1, 80055 Portici, Italy;
2 Department of Agricultural Sciences, University of Napoli Federico II, Via Università, 100, 80055 Portici, Italy;
3 Consiglio Nazionale delle Ricerche, Istituto per i Sistemi Agricoli e Forestali del Mediterraneo—ISAFOM-CNR, P.le E. Fermi, 1, 80055 Portici, Italy.
Flavia.debenedetta@unina.it, matteo.giaccone@cnr.it, umberto.bernardo@ipsp.cnr.it
Introduzione
I cambiamenti climatici rappresentano una sfida crescente per l’agricoltura [1]. Uno dei principali risultati del cambiamento climatico è la variazione della nicchia ecologica di diverse specie [2,3], compresi gli insetti nocivi agricoli e forestali [4,5]. Parallelamente, la diffusione delle specie esotiche invasive è favorita dall’import-export di merci e dalla circolazione delle persone [6].
L’Italia è particolarmente vulnerabile agli insetti e alle invasioni biologiche a causa dei suoi numerosi punti di ingresso, come porti e aeroporti [7,8]. Inoltre, i paesi del bacino del Mediterraneo sono caratterizzati dal clima temperato caldo [9]. I cambiamenti climatici rendono queste aree più calde, aprendo la strada all’insediamento e all’acclimatazione delle specie invasive [10,11]. Le condizioni climatiche del territorio italiano, rese più favorevoli dai cambiamenti climatici, hanno permesso l’invasione di Halyomorpha halys (Stål) (BMSB) (Hemiptera: Pentatomidae), arrivata nel nord Italia nel 2012 per poi diffondersi in tutto il paese [10,12].
Halyomorpha halys, nota anche come cimice marmorata marrone o cimice asiatica, è un parassita polifago originario dell’Asia orientale che attacca fino a 300 piante ospiti agricole, orticole e ornamentali, tra cui la nocciola (Corylus avellana L.) [13,14]. Ciò è preoccupante perché la coltivazione della nocciola ha un ruolo strategico nelle economie agricole della Turchia e dell’Italia, nonché negli Stati Uniti, in Azerbaigian e in Georgia [15]. La Turchia, infatti, riesce a produrre il ∼72,9-85% dell’offerta mondiale di nocciola (circa 684.000 t nel 2021), seguita dall’Italia (circa 84.670 t nel 2021) [15,16]. In Italia, le principali regioni che contribuiscono alla produzione di nocciole sono il Piemonte (35% della produzione nazionale di nocciole nel 2021), seguito dal Lazio (29%), e Campania (28%) [17].
Con l’aumento della popolazione di H. halys, questa specie è diventata un parassita chiave per la gestione delle nocciole, diffondendosi rapidamente in Piemonte (2013), Lazio (2015) [18] e Campania (2018) [19]. La rapida crescita e l’invasività di H. halys nel territorio italiano sono legate a diversi fattori: temperatura media adeguata, varietà e abbondanza di piante ospiti sia spontanee che coltivate sul territorio [20,21]. Inoltre, anche la mancanza di efficaci agenti nativi di biocontrollo e l’influenza umana (movimento di persone e merci, siti di svernamento) contribuiscono alla diffusione di H. halys [21,22].
Il danno prodotto da H. halys sulle nocciole riguarda principalmente i frutti. Infatti, provoca diversi tipi di lesioni a seconda della fase di sviluppo del frutto in cui avviene la puntura [23,24]. Quando il danno si verifica durante l’espansione del guscio, la crescita del seme si ferma, inducendo un aborto traumatico (gusci vuoti) e possibile “cascola precoce”[25]. Se la puntura avviene durante l’espansione dell’embrione, il seme diventa raggrinzito e/o malformato [23]. Le nocciole cimiciate si formano se la puntura si verifica sia durante l’espansione del seme che durante la maturazione dei frutti [23]. Quest’ultimo tipo di danno provoca la formazione di tessuti suberificati e necrotici dal caratteristico profilo organolettico chiamato “cimiciato”, derivante da metaboliti secondari [16,26]. Le nocciole con difetto da cimiciato sono caratterizzate da amarezza e astringenza, dovute a un pool di diarileptanoidi, e ad un aroma tipico e sgradevole. Tuttavia, non sono ancora stati identificati specifici composti volatili responsabili dell’aroma sgradevole del cimiciato [26,27]. Inoltre, le nocciole cimiciate presentano varie altre alterazioni riguardanti la composizione lipidica e l’aumento della sensibilità all’ossidazione lipidica [16,28,29]. Queste alterazioni influenzano il gusto e la conservabilità del prodotto, rendendo le nocciole, in alcuni casi, non commestibili e non commerciabili [16,26]. Danni simili sulle nocciole possono essere causati da altre specie di insetti, come Gonocerus acuteangulatus (Goeze) (Hemiptera: Coreidae), Nezara viridula L. (Hemiptera: Pentatomidae), Palomena prasina L. (Hemiptera: Pentatomidae), Piezodorus lituratus (Fabricius) (Hemiptera: Pentatomidae), Dolycoris baccarum L. (Hemiptera: Pentatomidae), e Rhaphigaster nebulosa Poda (Hemiptera: Pentatomidae) [30-33]. Sfortunatamente, H. halys sembra più dannosa delle cimici nocciolaie locali; infatti, provoca le più alte percentuali di semi danneggiati, più nocciole ammuffite, marce e più sintomi esterni [31]. Halyomorpha halys tende a dominare rapidamente l’ecosistema invaso, prevalendo sugli altri pentatomidi [34,35]. Inoltre, gli insetticidi disponibili sono inefficaci contro H. halys a causa della loro breve attività residua e del basso effetto knock-down iniziale [36,37].
L’elevata polifagia di questa specie permette la presenza di molti esemplari di cimice asiatica anche nei dintorni della coltura trattata; questi non subiscono direttamente il trattamento fatto sulla coltura e infestano il campo in seguito [21]. Ciò aumenta la necessità di applicazioni di pesticidi, con conseguenti perdite economiche ed effetti negativi sull’ambiente e sulla salute [38]. Con queste premesse, risulta sempre più necessario migliorare la conoscenza di H. halys in relazione a specifici ambienti agricoli e cultivar di nocciole.
Nel presente studio, è stata eseguita una prova di campo per raccogliere informazioni utili a migliorare le strategie di gestione sostenibile della cimice asiatica nelle nocciole, con i seguenti obiettivi: (a) valutare l’intensità del danno da cimiciato nei noccioleti di due diverse cultivar (una a maturazione precoce e una tardiva) in relazione allo sviluppo del nocciolo; b) valutare in che modo la densità degli adulti di H. halys varia nei noccioleti fino alla raccolta delle nocciole; c) valutare l’eventuale relazione tra la densità delle cimici in un particolare stadio fenologico delle nocciole e l’incidenza dei frutti danneggiati; d) valutare se i trattamenti normalmente effettuati nei noccioleti possano ridurre i danni dei frutti ad un livello accettabile.
1. Materiali e metodi
1.1 Progettazione sperimentale, luogo e materiali vegetali
La sperimentazione è stata condotta nel 2022 in un corileto (Corylus avellana) (circa 20 ha) situato a Teano (CE), regione Campania (Italia meridionale). La prova è stata eseguita in due appezzamenti, uno per ogni cultivar, a circa 200 m di distanza. Le cultivar sono San Giovanni (piantata nel 2015) e Tonda Romana (piantata nel 1987). Il sesto d’impianto era 5m tra le file e 4 m tra le piante nella fila. Gli alberi hanno una forma di allevamento a vaso con quattro rami principali.
Sono state valutate due strategie di gestione dei parassiti: lotta integrata (IPM o Integrated Pest Management) e assenza di insetticidi (NI o no insetticidi). Le date di applicazione, le quantità per ettaro e le formulazioni dei trattamenti insetticidi utilizzati nello studio sono mostrate nella Tabella 1. Nel marzo 2022, 80 piante di ogni cultivar sono state selezionate per la prova (10 piante in 8 file diverse) nella parte centrale della piantagione corrispondente, evitando le parti confinanti. In ogni appezzamento selezionato, le prime due file di alberi sono state trattate secondo i principi IPM (tesi IPM-SG e IPM-TR). Gli alberi rimanenti non sono stati trattati con insetticidi. I campioni per la tesi NI sono stati raccolti solo dalle due file centrali (5 e 6) (tesi NI-SG, NI-TR), mentre le due file su ciascun lato (3-4 e 7-8) formavano una zona cuscinetto per evitare la contaminazione da parte dell’insetticida. Un blocco di quattro alberi (due piante per ogni fila) è stato considerato una replica per lo studio della fenologia del frutto (cinque repliche in totale, due file di venti piante).
1.2 Presenza della cimice asiatica: attività di monitoraggio
Tre trappole sono state posizionate intorno al campo sperimentale il 3 maggio 2022 (il 123° giorno dell’anno, DOY- Day Of the Year) a circa 250-400 m di distanza. Le trappole erano costituite da un tubo cilindrico nero in polipropilene (diametro del tubo: 15 cm; lunghezza del tubo: 60 cm) [39,40] (Figura 1). Una parte del tubo è stata chiusa con una rete per impedire agli insetti di uscire. La parte opposta consisteva in un imbuto a rete che permette l’ingresso degli insetti ma non l’uscita. Una piastra bianca attaccata al tubo permette alla trappola di ruotare con il vento.
Le trappole sono state innescate con attrattivi potenziati Pherocon BMSB (Trécé, Adair, OK, USA). Sebbene questo sia un feromone specifico, si basa su feromoni di aggregazione che possono anche attrarre altri pentatomidi [41]. Questo può aiutare a determinare la presenza di cimici nocciolaie locali [42]. Le trappole sono state controllate ogni 6-8 giorni dal 130° al 262° DOY. Durante il campionamento, gli insetti sono stati raccolti dalle trappole e trasportati in laboratorio per l’identificazione morfologica utilizzando la chiave tassonomica disponibile [43]. Gli esemplari adulti di H. halys sono stati sessati a partire dal 145° DOY. La presenza di cimice asiatica è stata stimata effettuando la media delle catture dalle tre trappole in ogni data. I dati sono stati espressi in percentuale di catture alla settimana rispetto al numero totale di esemplari catturati durante l’intero periodo di monitoraggio (% catture totali, TC).
Oltre alle trappole, è stato eseguito un monitoraggio tramite scuotimento (frappage) delle piante seguendo il protocollo di Bosco et al. (2018) per verificare la presenza delle altre cimici nocciolaie in quanto non ci sono attrattivi disponibili in commercio specifici per gli altri pentatomidi [31].

1.3 Crescita dei frutti e classificazione fenologica
Venti nocciole sono state raccolte settimanalmente in modo casuale (da San Giovanni dal 130° al 236° DOY e Tonda Romana dal 130° al 243° DOY) dai cinque blocchi di nocciole. Questo campione è stato utilizzato per lo studio fenologico. Le nocciole sono state raccolte dalle seguenti quattro direzioni di ciascun blocco: nord-est, sud-est, sud-ovest e nord-ovest. Le principali misurazioni biometriche sono state raccolte utilizzando un calibro digitale, come mostrato nella Figura 2. La classificazione dello sviluppo dei frutti, utilizzata in questo studio, è stata sviluppata da noi sulla base del metodo di classificazione proposto da Hedtrom et al. (2014) [23]. La classificazione utilizzata nel nostro studio consiste in sette fasi, principalmente basate sulla percentuale del volume di nocciola occupato dall’embrione/seme. I volumi del seme e della nocciola sono stati approssimati a un ellissoide. In particolare, l’espansione del guscio descritta da Hedstrom corrisponde alla fase 1; l’espansione del seme (classificazione di Hedstrom) è stata divisa in quattro momenti, dalla fase 2 alla fase 5 all’espansione completa del seme (classificazione di Hedstrom) è stata assegnata la fase sei ed in più si è stabilita una settima fase in funzione del viraggio del colore del guscio (Figura 3). Ad ogni frutto/campione selezionato è stato assegnato un valore numerico corrispondente alle fasi fenologiche precedentemente descritte (venti nocciole per ogni cultivar e tesi).


1.4 Raccolta e valutazione del danno
Al fine di valutare l’incidenza del cimiciato, è stato raccolto casualmente un campione di 10 frutti per 10 alberi (n = 100; di cui 50 frutti sono stati raccolti durante la prima raccolta commerciale e 50 frutti durante la seconda raccolta commerciale) ed è stato raccolto casualmente per ogni tesi di nocciola (IPM-SG; NI–SG; IPM-TR; NI–TR). Questi campioni sono stati essiccati fino a un’umidità commerciale del 6% secondo le linee guida della Commissione economica per l’Europa delle Nazioni Unite (UNECE) per la commercializzazione delle nocciole in guscio [44]. Le nocciole sono state sgusciate e ispezionate visivamente per rilevare eventuali danni da cimici, sia esternamente (visibili sulla superficie del seme) che internamente (ispezione del frutto tagliando il seme in quattro parti).
Sulla base dell’ispezione visiva, i semi sono stati classificati come sani, raggrinziti o cimiciati (danni esterni e/o interni). Inoltre, tutte le nocciole sono state classificate come cimiciate dopo che due ricercatori le hanno assaggiate per confermare la classificazione visiva. I ricercatori che hanno riconosciuto il tipico difetto da cimiciato coinvolti nello studio erano esperti assaggiatori. Le quattro porzioni di ogni presunta nocciola cimiciata, tagliate durante l’ispezione preliminare, sono state assegnate casualmente dai due assaggiatori (due porzioni ciascuna). La valutazione è stata effettuata in modo indipendente, senza alcuna possibilità di comunicazione tra gli assaggiatori. I frutti vuoti non sono stati inclusi nello studio della valutazione del danno in quanto è impossibile distinguere se il danno è stato causato dall’azione delle cimici o da fattori climatici e fisiologici [45-47].
1.5 Analisi statistica
Per valutare l’incidenza di cimiciato e nocciole raggrinzite per le variabili “cultivar” e “pesticida” e le interazioni è stata effettuata un’analisi GLM. Il confronto delle produzioni di alberi tra le tesi trattate è stato valutato mediante ANOVA one-way (α = 0,05) utilizzando il test HSD Tukey post hoc. Il test di Kruskal-Wallis (α = 0,05) è stato utilizzato per valutare le differenze nella fase fenologica tra le diverse date. Tutte le analisi statistiche sono state eseguite utilizzando SPSS 28 (IBM, Chicago, IL, USA).
2. Risultati
2.1 Densità di popolazione di Halyomorpha halys
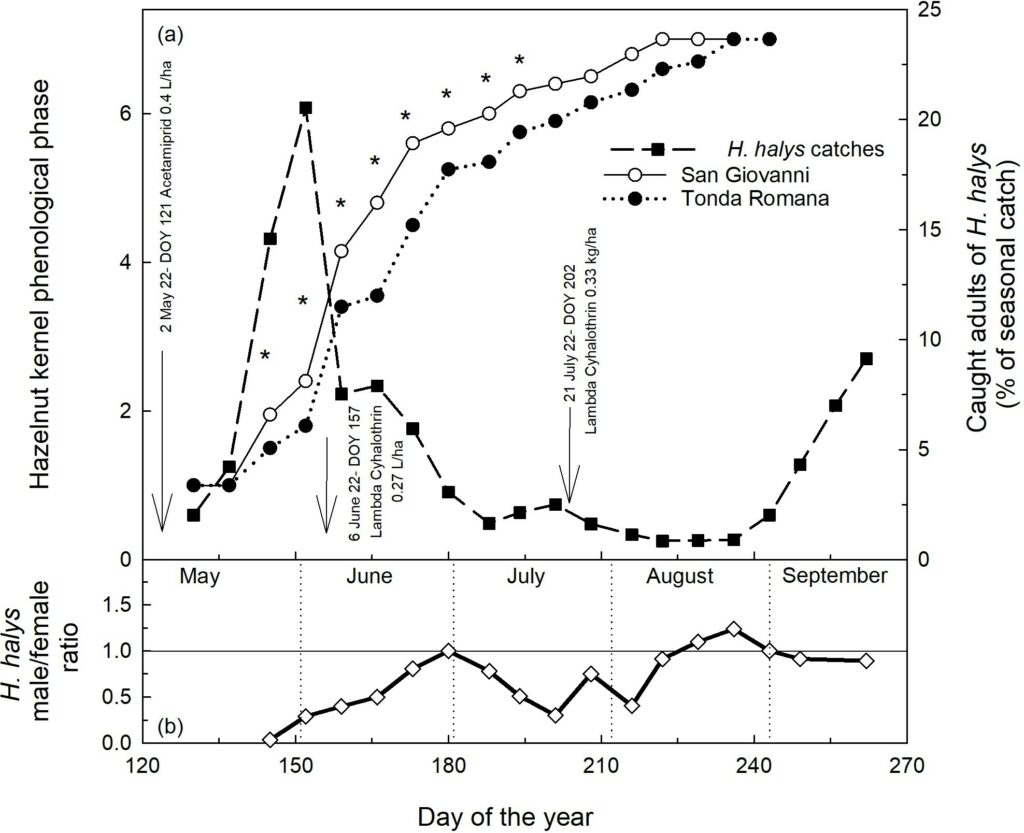
La densità di H. halys sul campo, rappresentata dalle catture nelle trappole (%TC), è illustrata nella figura 4a. La più alta densità di H. halys nei campi di nocciole è stata registrata durante l’intervallo tra il 145° e il 159° DOY (Figura 4a). Circa il 20,5% del totale degli esemplari catturati (355) sono stati registrati al 152° DOY.
Il rapporto tra i sessi durante il periodo di campionamento è mostrato nella figura 4b.
I campionamenti con lo scuotimento delle piante hanno mostrato una popolazione molto bassa di cimici diverse da H. halys. Occasionalmente, solo pochi esemplari di P. prasina e N. viridula sono stati registrati in trappole e durante i campionamenti con scuotimento delle piante. Pertanto, la loro presenza può essere considerata irrilevante ai fini del presente studio.
2.2 Crescita dei frutti
La figura 4a mostra la fase fenologica media per le due cultivar in ogni data di campionamento. Le curve di crescita di entrambe le cultivar hanno una forma sigmoidea, con la parte ascendente della curva che presenta un punto di flesso corrispondente ad una fase fenologica media di 5.60 (173° DOY) per San Giovanni e 5.25 (180° DOY) per Tonda Romana. Dopo questi punti di flessione, i tassi di crescita hanno rallentato.
Nelle prime due date di campionamento (130° e 137° DOY), le due cultivar erano in fase 1, cioè espansione del guscio senza embrione (Figura 3(1), Figura 4a). Dalla terza data di campionamento (145° DOY) in poi, la cultivar San Giovanni ha mostrato uno sviluppo del frutto più precoce rispetto a quello della Tonda Romana (Figura 4a). Le differenze nella crescita fenologica per data sono mostrate nella figura 4a [gli asterischi indicano differenze significative secondo i risultati di Kruskal-Wallis (p < 0,05)]. Per entrambe le cultivar, l’applicazione di pesticidi non ha influito sulla dimensione del frutto/embrione.
2.3 Raccolta e valutazione del danno
Le diverse tendenze di sviluppo dei frutti delle due cultivar hanno portato a diverse date di maturazione e raccolta. La produzione (nocciole in guscio al 6% di umidità) è stata di circa 2,8 t/ha (circa 5,8 kg/albero) per la cultivar San Giovanni e di 2,2 t/ha (circa 4,5 kg/albero) per Tonda Romana. Per entrambe le cultivar, non sono state rilevate differenze significative nella produzione tra IPM e trattamento NI (nel confronto tra NI e IPM per la cultivar SG, df = 1, F = 1.059, p = 0.317, mentre per la cultivar TR, df = 1, F = 0.734, p = 0.403).
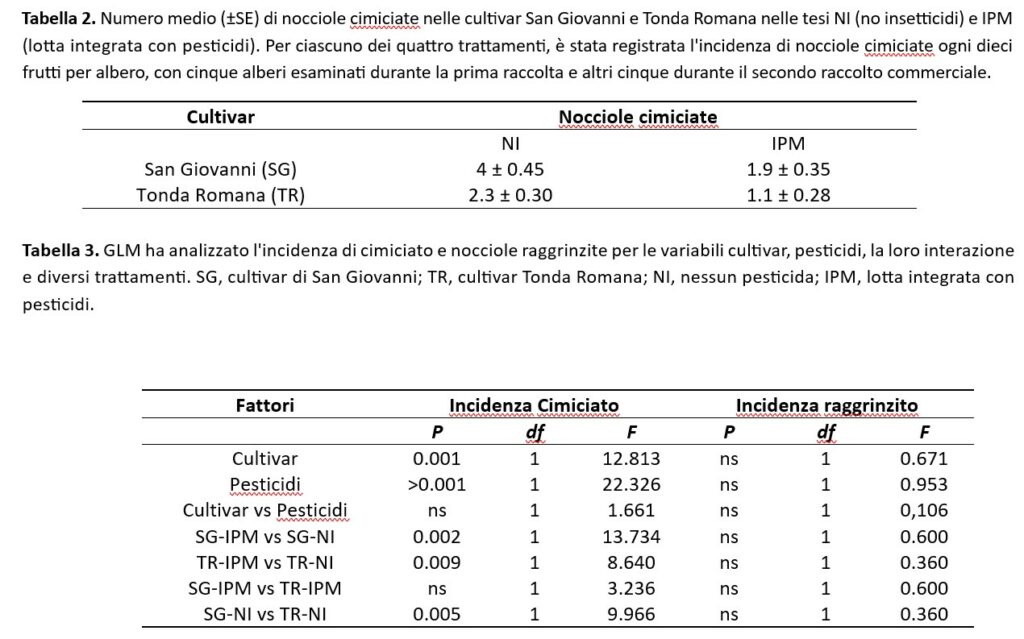
La tabella 2 riporta l’incidenza delle nocciole cimiciate sia per le cultivar che per le tesi (IPM e NI). Durante la valutazione del danno in laboratorio, i due assaggiatori hanno confermato che tutte le nocciole giudicate come cimiciate dall’esame visivo avevano il tipico sapore e aroma da cimiciato. Quando sono stati applicati insetticidi (SG-IPM vs TR-IPM), non sono state riscontrate differenze significative tra le cultivar in termini di incidenza di cimiciato e nocciole raggrinzite (Tabella 3). Al contrario, in assenza di trattamenti insetticidi (SG-NI vs. TR-NI), l’incidenza del danno da cimiciato era maggiore nella cultivar San Giovanni (Tabella 3). I trattamenti antiparassitari e la cultivar hanno influenzato l’incidenza del cimiciato; l’interazione tra questi fattori era insignificante (Tabella 3). Non sono state riscontrate differenze statisticamente significative nell’incidenza di nocciole raggrinzite tra le cultivar (con o senza insetticida) (Tabella 3).
3. Discussioni
Sebbene il danno delle cimici nocciolaie sulla nocciola sia ben noto, pochi articoli hanno valutato scientificamente la sua incidenza [31,47]. Il nostro studio ha evidenziato che l’intensità del danno da cimiciato è notevole, raggiungendo un valore medio in assenza di trattamenti insetticidi del 23% per la cultivar Tonda Romana e del 40% per la cultivar San Giovanni. Il danno è stato maggiore di quello osservato da Bosco et al. (2018) (13,98% nel 2015 e 14,58% nel 2016) in un frutteto gestito in modo simile nelle stesse condizioni di assenza di insetticidi [31]. Le differenze possono essere attribuibili alla diversa cultivar (Tonda Gentile Trilobata), al clima (Nord ovest vs. Italia meridionale), all’anno (2015-2016 vs. 2022) e alle specie di cimice (nessuna presenza di H. halys nel caso di Bosco et al.) [31].
Come dimostrato dal nostro monitoraggio (battitura delle piante e cattura tramite trappole), il danno da cimiciato osservato durante questo studio è stato determinato quasi esclusivamente da esemplari di H. halys. Questo risultato è coerente con ciò che è stato registrato in studi precedenti sulla soia [35] e su pomacee [34], dove si è osservato che H. halys diventa la specie dominante di cimice nel territorio appena invaso dopo circa tre anni dal suo arrivo [35]. Questo è coerente con il primo rilevamento di H. halys in Campania avvenuto nel 2018 [19]. Inoltre, H. halys sembra essere la specie più dannosa, causando i maggiori danni ai semi rispetto ad altre specie di cimici [31].
Le percentuali registrate di danno da cimiciato sono economicamente insostenibili, soprattutto se i valori riportati escludono il danno del vuoto traumatico, che non può essere attribuito con certezza all’attività trofica delle cimici [45,46].
Come evidenziato nella Tabella 2, il maggior danno da cimiciato è stato riscontrato nella cultivar precoce (SG). Lo studio della fenologia del frutto ha dimostrato che le due cultivar hanno raggiunto stadi fenologici in tempi diversi, distanziati di circa 12,5 giorni l’uno dall’altro. La nuova classificazione fenologica utilizzata in questo articolo consente la distinzione di diverse fasi durante l’espansione del seme, a differenza della classificazione utilizzata da Hedstrom et al. (2014) [23]. La scelta di un maggior numero di fasi è stata fatta per cercare di evidenziare più chiaramente se il frutto presenta una diversa vulnerabilità e diverse intensità dei sintomi del cimiciato se punto in diversi stadi di crescita del seme. Sono necessari ulteriori studi per approfondire questa tematica [47]. Finora non vi erano studi sugli stadi fenologici dello sviluppo del frutto di Tonda Romana e San Giovanni.
Come mostrato nella figura 4a, una grande popolazione di adulti di H. halys si è trasferita nei noccioleti subito dopo lo svernamento. Ciò è coerente con altre osservazioni che segnalano la presenza di un picco più ampio di adulti emergenti da rifugi di svernamento sperimentali tra metà maggio e inizio giugno [48,49]. Ciò è anche coerente con Bosco et al. (2018) [31], che hanno riferito che durante le attività di monitoraggio in un noccioleto nella Georgia occidentale, hanno registrato catture precoci da metà giugno a causa della popolazione svernante. Questa colonizzazione precoce non è stata osservata negli altri tre frutteti (uno nell’Italia nord-occidentale e due nella Georgia occidentale), dove il picco maggiore si è verificato nella tarda stagione [31]. Generalmente, alti picchi precoci indicano una popolazione più alta per quell’anno [50,51].
Il rapporto tra i sessi nella prima parte della stagione dopo lo svernamento era sbilanciato verso le femmine (Figura 4b). Questa è un’altra variabile da considerare perché le femmine sono più voraci dei maschi in diverse specie pentatomidi, per le quali una maggiore presenza di femmine in un determinato periodo potrebbe causare danni maggiori [24,52]. Le differenze nell’incidenza del cimiciato nella tesi senza insetticidi (SG-NI vs. TR-NI) può essere dovuto a diversi fattori. Tuttavia, l’analisi delle fasi fenologiche ci permette di affermare che durante il periodo di massima densità di H. halys, la cultivar precoce (SG) era nelle fasi di espansione del seme. Queste sono le fasi più sensibili dello sviluppo del frutto per l’insorgenza del difetto da cimiciato, coerenti con studi precedenti su G. acuteangulatus, P. prasina [24] e H. halys [23]. Questi studi hanno indicato che il tipo di danno al frutto è fortemente correlato al momento dell’attacco da parte delle cimici in relazione allo sviluppo del frutto. Pertanto, l’elevata incidenza di cimiciato (40%) registrata nella San Giovanni dovrebbe essere dovuta all’elevata densità di H. halys, con il 42,65% delle catture totali registrate tra il 145° e il 159° DOY. Questo periodo coincise con la fase fenologica dell’espansione del seme, durante la quale i frutti della cultivar SG erano prevalentemente negli stadi da due a quattro. Inoltre, questo periodo era caratterizzato anche da una maggiore presenza di femmine.
Al contrario, l’alta densità della popolazione di H. halys non coincideva con la fase fenologica più suscettibile della TR. In effetti, i frutti di questa cultivar erano fino al 152° DOY nella fase di espansione del guscio (i frutti non hanno raggiunto il secondo stadio, presenza dell’embrione).
Ciò spiegherebbe i diversi livelli di danno da cimiciato registrati nelle due cultivar coltivate nello stesso frutteto commerciale (tabella 2).
I trattamenti insetticidi hanno influenzato la densità di H. halys e l’incidenza del cimiciato. Tuttavia, il primo trattamento con acetamiprid (Tabella 1, Figura 4a) è stato eseguito troppo presto rispetto sia alla presenza di esemplari di H. halys che alla presenza di frutti per entrambe le cultivar (121° DOY). Diversamente, il secondo e il terzo trattamento con lamba-cialotrina (157° e 202° DOY) hanno causato una diminuzione efficace della densità di popolazione di H. halys. L’efficacia della lamba-cialotrina nel controllo di H. halys è almeno parzialmente coerente con risultati precedenti [53]. Tuttavia, i trattamenti chimici non hanno ridotto l’incidenza del danno cimiciato ad un livello accettabile (19% SG e 11% TR). D’altra parte, la riduzione dell’incidenza percentuale di cimiciato nella SG-IPM è stata molto elevata (dal 40% al 19%), e ciò dovrebbe essere dovuto al primo trattamento effettuato con acetamiprid. Questo principio attivo sistemico e persistente può aver protetto i frutti durante le loro fasi fenologiche vulnerabili [54,55].
L’analisi della presenza di H. halys nei noccioleti e la fase fenologica dei frutti hanno mostrato che i primi due trattamenti non sono stati effettuati nel momento migliore per controllare la cimice. Il primo doveva essere ritardato, mentre il secondo anticipato; pertanto, è necessario apportare miglioramenti alla strategia IPM.
La popolazione di H. halys è aumentata di nuovo dopo la maturazione e il primo raccolto. Ciò è probabilmente dovuto all’assenza di altri trattamenti, allo sviluppo della seconda generazione e al fatto che l’area è un probabile sito di svernamento.
Nonostante la forte riduzione del danno da cimiciato registrata per entrambe le cultivar, i risultati hanno mostrato che i trattamenti insetticidi effettuati sulle tesi IPM non hanno fornito una protezione sufficiente. I risultati di queste attività di ricerca hanno forti implicazioni per le future strategie IPM. I risultati hanno mostrato che per gestire H. halys, è essenziale analizzare simultaneamente la densità del parassita e la fenologia del frutto delle diverse cultivar. In particolare, è molto importante studiare la fenologia dei frutti per identificare quando sono più vulnerabili ai danni. Questo studio evidenzia anche l’importanza di differenziare le strategie di difesa in base allo sviluppo della cultivar. Infine, conoscere la densità della popolazione di parassiti nel frutteto è essenziale per identificare il momento migliore per applicare trattamenti chimici. Ciò è particolarmente importante quando la generazione svernante arriva precocemente nei noccioleti, indicando densità di popolazione più elevate [51]. In questi casi, come in questo studio, il trattamento con un principio attivo persistente è raccomandato all’inizio dell’infestazione. I trattamenti devono mirare a mantenere la densità della popolazione di H. halys molto bassa durante le fasi fenologiche più sensibili (sviluppo del seme) dello sviluppo del frutto.
4. Conclusioni
L’analisi complessiva dei danni ha mostrato che: (1) la popolazione di H. halys, in alcune località, arriva rapidamente ai noccioleti subito dopo lo svernamento. Vi sono due generazioni all’anno, oltre agli esemplari della seconda generazione che svernano; (2) il danno alle nocciole dovuto a H. halys è stato molto elevato; (3) la cv precoce (SG) in assenza di trattamenti insetticidi era più danneggiata di quella tardiva (TR); (4) danni maggiori sembrano essere collegati, almeno a Caserta, ad un attacco precoce di H. halys; (5) I trattamenti IPM dovrebbero essere necessariamente collegati all’uso di trappole e al monitoraggio della fenologia del frutto per ottenere la massima efficacia.
Finanziamento: La ricerca è stata svolta nell’ambito del progetto di dottorato di F.d.B. Questo dottorato di ricerca è stato finanziato da V. Besana S.p.A., San Gennaro Vesuviano (Napoli), Italia, e dal Consiglio Nazionale delle Ricerche (CNR), Roma, Italia.
Referenze
- Gruppo intergovernativo di esperti sul cambiamento climatico. Climate Change 2007: The Physical Science Basis; Gruppo intergovernativo di esperti sul cambiamento climatico: Ginevra, Svizzera, 2007; Volume 4, p. 333.
- Wiens, J.A.; Stralberg, D.; Jongsomjit, D.; Howell, C.A.; Snyder, M.A.; Grinnell, J.; Elton, C. Nicchie, modelli e cambiamenti climatici: valutare le ipotesi e le incertezze. Proc. Natl. Acad. Sci. USA 2009, 106 (Suppl. S2), 19729–19736. [CrossRef]
- De Benedetta, F.; Gargiulo, S.; Miele, F.; Figlioli, L.; Innangi, M.; Audisio, P.; Nugnes, F.; Bernardo, U. The spread of Carpophilus truncatus è sul filo del rasoio tra un’epidemia e un’invasione di parassiti. Sci. Rep. 2022, 12, 18841. [CrossRef]
- Nugnes, F.; Russo, E.; Viggiani, G.; Bernardo, U. Prima registrazione di un moscerino della frutta invasivo appartenente a Bactrocera dorsalis complesso (Ditteri: Tephritidae) in Europa. Insetti 2018, 9, 182. [CrossRef]
- Sweeney, J.; Rassati, D.; Meurisse, N.; Hurley, B.; Duan, J.; Stauffer, C.; Battisti, A. Numero speciale sui parassiti invasivi delle foreste e degli alberi urbani: percorsi, diagnosi precoce e gestione. J. Pest. Sci. 2019, 92, 1–2. [CrossRef]
- Gargiulo, S.; Nugnes, F.; de Benedetta, F.; Bernardo, U. Bactrocera latifrons in Europa: l’importanza dell’attrattivo giusto per il rilevamento. Toro. Insectologia 2021, 74, 311-320.
- Capinha, C.; Essl, F.; Porto, M.; Seebens, H. Le reti mondiali di diffusione delle specie aliene registrate. Proc. Natl. Acad. Sci. USA 2023, 120, e2201911120. [CrossRef]
- Pace, R.; Ascolese, R.; Miele, F.; Russo, E.; Griffo, R.V.; Bernardo, U.; Nugnes, F. Gli insetti nelle borse: il rischio associato all’introduzione di piccole quantità di frutta e piante da parte dei passeggeri aerei. Insetti 2022, 13, 617. [CrossRef]
- Enciclopedia Britannica. Disponibile online: https://www.britannica.com/science/Mediterranean-climate (consultato il 23 febbraio 2023).
- Stoeckli, S.; Felber, R.; Haye, T. Distribuzione attuale e voltinismo della cimice marmorata marrone, Halyomorpha halys, in Svizzera e la sua risposta ai cambiamenti climatici utilizzando un modello CLIMEX ad alta risoluzione. Int. J. Biometeorol. 2020, 64, 2019–2032. [CrossRef]
- Seebens, H.; Blackburn, T.M.; Tintore, E.E.; Genovesi, P.; Hulme, P.E.; Jeschke, J.M.; Pagad, S.; Pyšek, P.; Inverno, M.; Arianoutsou, M.; et al. Nessuna saturazione nell’accumulo di specie esotiche in tutto il mondo. Nat. Commun. 2017, 8, 14435. [CrossRef]
- Streito, J.C.; Chartois, M.; Pierre É.; Dusoulier, F.; Armand, J.M.; Gaudin, J.; Rossi, J.P. Citizen science e modellazione di nicchia per tracciare e prevedere l’espansione della cimice marmorata marrone Halyomorpha halys (Stål, 1855). Sci. Rep. 2021, 11, 11421. [CrossRef]
- Giovannini, L.; Mazza, G.; Chitarra, W.; Sabbatini-Peverieri, G.; Sonnati, C.; Roversi, P.F.; Nerva, L. New insights from the virome of Halyomorpha halys (Stål, 1855). Virus Res. 2022, 316, 198802. [CrossRef] [PubMed]
- Chen, J.H.; Avila, G.A.; Zhang, F.; Guo, L.F.; Sandanayaka, M.; Mi, Q.Q.; Shi, S.S.; Zhang, J.P. Valutazione della gabbia da campo dei danni da alimentazione da parte di Halyomorpha halys sui frutteti di kiwi in Cina. J. Pest. Sci. 2020, 93, 953–963. [CrossRef]
- FAOSTAT. Disponibile online: https://www.fao.org/faostat/en/#data/QCL (consultato il 23 febbraio 2023).
- Singldinger, B.; Dunkel, A.; Hofmann, T. L’asadanina diarileptanoide ciclica come principale contributore al gusto amaro nelle nocciole (Corylus avellana L.). J. Agric. Food Chem. 2017, 65, 1677–1683. [CrossRef] [PubMed]
- Istat. Disponibile online: https://www.istat.it/ (consultato il 22 febbraio 2023).
- Cianferoni, F.; Graziani, F.; Dioli, P.; Ceccolini, F. Revisione del verificarsi di Halyomorpha halys (Hemiptera: Heteroptera: Pentatomidae) in Italia, con un aggiornamento della sua distribuzione europea e mondiale. Biologia 2018, 73, 599–607. [CrossRef]
- Regione Campania, Decreto Dirigenziale Numero 28 del 20 March 2019; BURC Regione Campania: Napoli, Italy, 2019.
- Cesari, M.; Maistrello, L.; Ganzerli, F.; Dioli, P.; Rebecchi, L.; Guidetti, R. Un’invasione aliena di parassiti in corso: potenziali vie di origine della cimice marmorata bruna Halyomorpha halys popolazioni in Italia. J. Pest. Sci. 2015, 88, 1–7. [CrossRef]
- Maistrello, L.; Vaccari, G.; Caruso, S.; Costi, E.; Bortolini, S.; Macavei, L.; Foca, G.; Ulrici, A.; Bortolotti, P.P.; Nannini, R.; et al. Monitoraggio dell’invasivo Halyomorpha halys, un nuovo parassita chiave dei frutteti nel nord Italia. J. Pest. Sci. 2017, 90, 1231–1244. [CrossRef]
- Costi, E.; Haye, T.; Maistrello, L. Rilevamento di parassitoidi autoctoni delle uova e predatori dell’invasivo Halyomorpha halys nel nord Italia. J. Appl. Entomol. 2019, 143, 299–307. [CrossRef]
- Hedstrom, C.S.; Shearer, P.W.; Miller, J.C.; Walton, V.M. Gli effetti dell’alimentazione del kernel da parte di Halyomorpha halys (Hemiptera: Pentatomi- dae) su nocciole commerciali. J. Econ. Entomol. 2014, 107, 1858–1865. [CrossRef]
- Hamidi, R.; Calvy, M.; Valentie, E.; Driss, L.; Guignet, J.; Tommaso, M.; Tavella, L. Sintomi derivanti dall’alimentazione di veri insetti sulle nocciole in crescita. Entomol. Exp. Appl. 2022, 170, 477–487. [CrossRef]
- Tavella, L.; Arzone, A.; Miaja, M.L.; Sonnati, C. Influenza dell’attività alimentare degli insetti (Heteroptera, Coreidae e Pentatomidae) sulla nocciola nell’Italia nord-occidentale. Acta Hortic. 2001, 556, 461–468. [CrossRef]
- Singldinger, B.; Dunkel, A.; Bahmann, D.; Bahmann, C.; Kadow, D.; Bisping, B.; Hofmann, T. Nuovo gusto-attivo 3-(O-β-d- Acidi glucosil)-2-ossoindolo-3-acetico e diarileptanoidi in cimiciato-nocciole infette. J. Agric. Food Chem. 2018, 66, 4660–4673. [CrossRef] [PubMed]
- Squara, S.; Stilo, F.; Cialiè Rosso, M.; Liberto, E.; Spigolon, N.; Genova, G.; Castello, G.; Bicchi, C.; Cordero, C. Corylus avellana L. Progetto aromatico: potenti firme di odori nel volatile delle nocciole di alta qualità. Fronte. Pianta Sci. 2022, 13, 840028. [CrossRef]
- Memoli, A.; Albanese, D.; Esti, M.; Lombardelli, C.; Crescitelli, A.; di Matteo, M.; Benucci, I. Effetto del danno da insetti e della contaminazione da muffe sugli acidi grassi e sugli steroli dell’olio di nocciola. Eur. Food Res. Technol. 2017, 243, 651–658. [CrossRef]
- Turan, A. Effetto dei danni causati dall’insetto scudo verde (Palomena prasina L.) sui tratti qualitativi delle nocciole. Grasas Aceites 2021, 72, 1135192.
- Viggiani, G. Nematodi, Acari e Insetti Dannosi al Nocciuolo; Annali della Facoltà di Scienze Agrarie dell’Università di Napoli: Napoli, Italia, 1972; p. 6.
- Bosco, L.; Moraglio, S.T.; Tavella, L. Halyomorpha halys, una seria minaccia per la nocciola nelle aree appena invase. J. Pest. Sci. 2018, 91, 661–670. [CrossRef]
- Pollini, A. Manuale di Entomologia Applicata; Edagricole-Edizioni Agricole: Bologna, Italy, 2013.
- Ak, K.; Uluca, M.; Tunçer, C. Distribuzione e densità di popolazione Halyomorpha halys (Stål, 1855) (Hemiptera: Pentatomidae) in Black Sea Region of Türkiye. Turco. J. Zool. 2023, 47, 120–129. [CrossRef]
- Nielsen, A.L.; Hamilton, G.C. Presenza stagionale e impatto di Halyomorpha halys (Hemiptera: Pentatomidae) nei frutti degli alberi. J. Econ. Entomol. 2009, 102, 1133–1140. [CrossRef] [PubMed]
- Nielsen, A.L.; Hamilton, G.C.; Shearer, P.W. Fenologia stagionale e monitoraggio dei non nativi Halyomorpha halys (Hemiptera: Pentatomidae) nella soia. Circondare. Entomol. 2011, 40, 231–238. [CrossRef]
- Leskey, T.C.; Lee, D.; Corto, B.D.; Wright, S.E. Impatto degli insetticidi sull’invasivo Halyomorpha halys (Hemiptera: Pentatomidae): Analisi della letalità degli insetticidi. J. Econ. Entomol. 2012, 105, 1726–1735. [CrossRef]
- Leskey, T.C.; Corto, B.D.; Lee, D. Efficacia dei residui di insetticidi sugli adulti Halyomorpha halys (Stål) (Hemiptera: Pentatomidae) mortalità e lesioni nei frutteti di mele e pesche. Peste. Gestione. Sci. 2014, 70, 1097–1104. [CrossRef]
- Leskey, T.C.; Corto, B.D.; Maggiordomo, B.R.; Wright, S.E. Impatto della cimice marmorata marrone invasiva, Halyomorpha halys (Stål), nei frutteti arborei del Medio Atlantico negli Stati Uniti: casi di studio di gestione commerciale. Psiche 2012, 2012, 1–14. [CrossRef]
- Allattante, D.M.; Levy, M.C.; Roselli, G.; Mazzoni, V.; Ioriatti, C.; Deromedi, M.; Cristofaro, M.; Anfora, G. Trappole vive per cimici marroni adulte. Insetti 2019, 10, 376. [CrossRef] [PubMed]
- Horner, R.; Roselli, G.; Sasso, R.; Cristofaro, M.; Chen, S.; Jermy, M.; Anfora, G. La trappola a tunnel: principi di progettazione aerodinamica per una migliore trappola marrone marmorata puzzolente. In Atti del Congresso internazionale sulle invasioni biologiche, Christchurch, Nuova Zelanda, 1-4 maggio 2023.
- Khrimian, A.; Zhang, A.; Weber, D.C.; Ho, H.Y.; Aldrich, J.R.; Vermillion, K.E.; Siegler, M.A.; Shirali, S.; Guzman, F.; Leskey, T.C. Scoperta del feromone di aggregazione della cimice marmorata bruna (Halyomorpha halys) attraverso la creazione di librerie stereoisomeriche di 1-bisabolen-3-oli. J. Nat. Prod. 2014, 77, 1708–1717. [CrossRef] [PubMed]
- Vandervoet, T.F.; Bellamy, D.E.; Anderson, D.; MacLellan, R. Cattura per l’individuazione precoce della cimice marmorata marrone, Halyomorpha halys, in Nuova Zelanda. N. Z. Protezione delle piante. Soc. 2019, 72, 36–43. [CrossRef]
- Wyniger, D.; Kment, P. Chiave per la separazione di Halyomorpha halys (Stål) da pentatomidi dall’aspetto simile (Insecta: Heteroptera: Pentatomidae) presenti in Europa centrale, con nuovi record svizzeri. J. Swiss Entomol. Soc. 2010, 83, 261–270.
- UNECE, Stati Uniti DDP-04 relativo alla commercializzazione e al controllo commerciale della qualità dei noccioli; Nazioni Unite: New York, NY, USA, 2010.
- Smith, A.P.; Ribeiro, R.M.; Smith, A.; Rosa, E. Frutti vuoti in nocciola (Corylus avellana L.) Cv. “Butler”: Caratterizzazione e influenza del clima. J. Hortic. Sci. 1996, 71, 709–720. [CrossRef]
- Fattahi, R.; Mohammadzedeh, M.; Khadivi-Khub, A. Influenza di diverse fonti di polline sulle caratteristiche di noci e noccioli di nocciola. Sci. Ortico. 2014, 173, 15–19. [CrossRef]
- De Benedetta, F.; Pica, F.; Improta, A.; Turrà, D.; Vinale, F.; Giaccone, M.; Lisanti, M.T.; Bernardo, U. Relationship between Halyomorpha halys (Stål) Densità della popolazione, suo danno e fenologia di tre cultivar di nocciola (Corylus avellana L). In Atti del XXVII Congresso Nazionale Italiano di Entomologia (CNIE), Palermo, Italia, 12-16 giugno 2023.
- Ak, K.; Tuncer, C.; Baltaci, A.; Eser, U.; Saruhan, I. Incidenza e gravità dei danni da cimici puzzolenti sui chicchi nei noccioleti turchi. Acta Hortic. 2018, 1226, 407–411. [CrossRef]
- Bergh, J.C.; Morrison III, W.R.; Giuseppe, S.V.; Leskey, T.C. Caratterizzazione dell’emergenza primaverile dell’adulto Halyomorpha halys Utilizzando rifugi sperimentali per lo svernamento e trappole commerciali a feromoni. Entomol. Exp. Appl. 2017, 162, 336–345. [CrossRef]
- Leskey, T.C.; Agnello, A.; Bergh, J.C.; Dively, G.P.; Hamilton, G.C.; Jentsch, P.; Khrimian, A.; Krawczyk, G.; Kuhar, T.P.; Lee, D.H.; et al. Attrazione dell’invasivo Halyomorpha halys (Hemiptera: Pentatomidae) alle trappole innescate con stimoli semiochimici attraverso Stati Uniti. J. Econ. Entomol. 2015, 44, 746–756. [CrossRef]
- Weber, D.C.; Morrison, W.R., III; Khrimian, A.; Riso, K.B.; Leskey, T.C.; Rodriguez-Saona, C.; Nielsen, A.L.; Blaauw, B.R. Ecologia chimica di Halyomorpha halys: Scoperte e applicazioni. J. Pest Sci. 2017, 90, 989–1008. [CrossRef]
- Smith, J.R.; Hesler, S.P.; Loeb, G.M. Impatto potenziale di Halyomorpha halys (Hemiptera: Pentatomidae) sulla produzione di uva nel finger lakes regione di New York. J. Entomol. Sci. 2014, 49, 290–303. [CrossRef]
- Preti, M.; Montanari, M.; Landi, M.; Cavazza, F.; Franceschelli, F.; Mirossevich, L.; Nannini, R.; Bortolotti, P.P. Screening in campo aperto e in laboratorio dell’attività insetticida dei piretroidi contro Halyomorpha halys. In Atti dell’Emilia-Romagna, Atti, Giornate Fitopatologiche, Chianciano Terme, Italia, 6-9 marzo 2018; Volume 1, pp. 403-414.
- Yao, X.; Min, H.; Lü, Z.; Yuan, H. Influenza dell’acetamiprid sulle attività enzimatiche del suolo e sulla respirazione. Eur. J. Suolo Biol. 2006, 42, 120–126. [CrossRef]
- Al-Rajab, A.J.; Alhababy, A.M.; Alfaifi, T. Persistenza di imidacloprid, acetamiprid e metomile nelle foglie di qat. Inferno. Pianta Prot. 2016, 9, 51–59. [CrossRef]
Copyright: NocciolaRe
Pubblicato 16-10-2023







